Penjelasan Ihwal Bentuk Orbital Pada Atom
Bentuk orbital ditentukan oleh bilangan kuantum azimut. Bilangan kuantum ini diperoleh dari suatu persamaan matematika yang mengandung trigonometri (sinus dan cosinus). Akibatnya, bentuk orbital ditentukan oleh bentuk trigonometri dalam ruang.
1. Orbital-s
Peluang terbesar keberadaan elektron dalam atom Inti atom Orbital-s mempunyai bilangan kuantum azimut, l = 0 dan m= 0. Oleh alasannya nilai m bersama-sama suatu tetapan (tidak mengandung trigonometri) maka orbital-s tidak mempunyai orientasi dalam ruang sehingga orbital-s ditetapkan berupa bola simetris di sekeliling inti. Permukaan bola menyatakan peluang terbesar ditemukannya elektron dalam orbital-s. Hal ini bukan berarti semua elektron dalam orbital-s berada di permukaan bola, tetapi pada permukaan bola itu peluangnya tertinggi ( ≈ 99,99%), sisanya bolehjadi tersebar di dalam bola, lihat Gambar berikut.
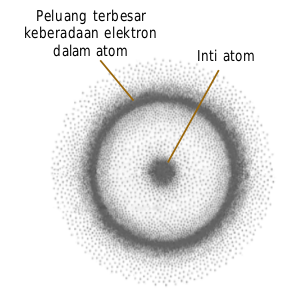
Peluang keberadaan elektron dalam atom. Peluang terbesar ( ≈ 99,99%) berada pada permukaan bola.
2. Orbital-p
Orbital-p mempunyai bilangan kuantum azimut, l = 1 dan m= 0, ±l. Oleh alasannya itu, orbital-p mempunyai tiga orientasi dalam ruang sesuai dengan bilangan kuantum magnetiknya. Oleh alasannya nilai m bersama-sama mengandung sinus maka bentuk orbital-p mirip bentuk sinus dalam ruang, mirip ditunjukkan pada Gambar berikut.
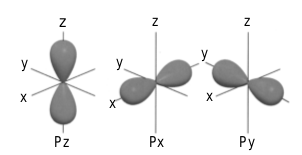
Kumpulan orbital p dengan banyak sekali orientasi.
Ketiga orbital-p mempunyai bentuk yang sama, tetapi berbeda dalam orientasinya. Orbital-p x mempunyai orientasi ruang pada sumbu-x, orbital-p y mempunyai orientasi pada sumbu-y, dan orbital-p z mempunyai orientasi pada sumbu-z. Makna dari bentuk orbital-p yaitu peluang terbesar ditemukannya elektron dalam ruang berada di sekitar sumbu x, y, dan z. Adapun pada bidang xy, xz, dan yz, peluangnya terkecil.
3. Orbital-d
Orbital-d mempunyai bilangan kuantum azimut l = 2 dan m = 0, ±1, ±2. Akibatnya, terdapat lima orbital-d yang melibatkan sumbu dan bidang, sesuai dengan jumlah bilangan kuantum magnetiknya. Orbital-d terdiri atas orbital- dz2 , orbital- d xz , orbital- d xy , orbital- d yz , dan orbital- d x2 - y2 (perhatikan Gambar 1.10).
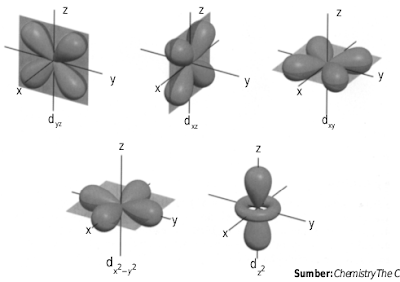
Kumpulan orbital d dengan banyak sekali orientasi.
Orbital d xy , d xz , d yz , dan d x 2 − y 2 mempunyai bentuk yang sama, tetapi orientasi dalam ruang berbeda. Orientasi orbital-d xy berada dalam bidang xy, demikian juga orientasi orbital-orbital lainnya sesuai dengan tandanya. Orbital d x 2 − y 2 mempunyai orientasi pada sumbu x dan sumbu y. Adapun orbital d z 2 mempunyai bentuk berbeda dari keempat orbital yang lain.
Orientasi orbital ini berada pada sumbu z dan terdapat “donat” kecil pada bidang-xy. Makna dari orbital-d adalah, pada daerah-daerah sesuai tanda dalam orbital (xy, xz, yz, x 2 –y 2 , z 2 ) menawarkan peluang terbesar ditemukannya elektron, sedangkan pada simpul-simpul di luar bidang mempunyai peluang paling kecil. Bentuk orbital-f dan yang lebih tinggi sanggup dihitung secara matematika, tetapi sukar untuk digambarkan atau diungkapkan keboleh- jadiannya sebagaimana orbital-s, p, dan d. Kesimpulan umum dari hasil penyelesaian persamaan Schrodinger sanggup dirangkum sebagai berikut.
Setiap orbital dicirikan oleh tiga bilangan kuantum n, , dan m yang mempunyai ukuran, bentuk, dan orientasi tertentu dalam ruang kebolehjadian. Elektron-elektron yang mengh
uni orbital mempunyai spin berlawanan sesuai temuan Stern-Gerlach.
Secara lengkap, peluang keberadaan elektron dalam atom sanggup Anda lihat pada Tabel berikut.
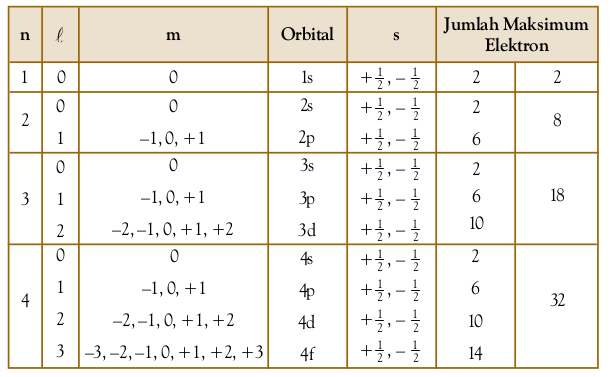
Tabel - Bilangan Kuantum dan Orbital Atom
Demikianlah bahan Kimia tentang Bentuk Orbital pada Atom ini aku sampaikan, supaya bermanfaat.
Belum ada Komentar untuk "Penjelasan Ihwal Bentuk Orbital Pada Atom"
Posting Komentar